Диоксид титана — химический состав и производство
Химический состав диоксида титана
Диоксид титана — вещество белого цвета, используемое в качестве пигмента (титановые белила) в виде бесцветного порошка с размером частиц 0.2 мкм, известно как пищевая добавка Е171. Кристаллы двуокиси титана существуют в природе в форме рутила (лат. rutilus — красный), анатаза (греч. anatasis — растяжение) и брукита. Первая является наиболее стабильной и чаще встречается в природе. Анатаз получил своё название из-за того, что вертикальная ось его кристалла длиннее вертикальной оси рутила. Брукит — наименее распространённая модификация вещества, не представляющая особой ценности.
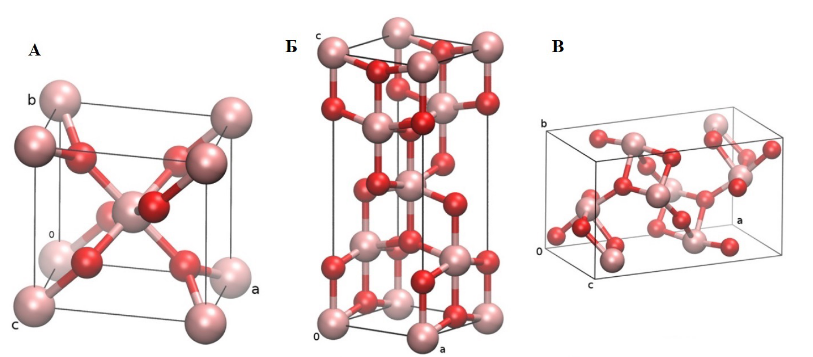
Элементарные ячейки рутила (А), анатаза (Б) и брукита (В), в составе которых атомы титана изображены бледно-красным, кислорода — ярко-красным.
Рутильная форма диоксида титана обладает большим коэффициентом преломления и отражающей способностью в сравнении с анатазной, из-за чего чаще применяется в роли пигмента. Добавка анатаза обладает похожими свойствами, но эта форма химически нестабильна и при повышении температуры переходит в рутил. Этот материал характеризуется меньшим показателем преломления, чем рутил, но более чувствителен к воздействию УФ-излучения, поэтому этот вид диоксида титана чаще используется для изготовления приборов фотокаталитической очистки. Но даже небольшое присутствие анатазной формы в составе рутила вызывает деструкцию ЛКМ под действием солнечного света.
Сравнение форм диоксида титана
|
Рутил |
Анатаз |
|
Более компактная форма кристалла |
Более голубой оттенок |
|
Выше показатель преломления, лучше укрывистость |
Слабее рассеивает ультрафиолет |
|
Инертность, атмосферостойкость |
|
|
Применяется в производстве ЛКМ, печатных красок и пластмасс |
Получение диоксида титана
Диоксид титана добывают из титансодержащих руд: рутилы, в которых содержится 93-96% двуокиси титана, ильмениты, где содержится 44-70% двуокиси титана, лейкоксены с содержанием диоксида титана до 90%. Известно два основных способа получения веществ, названных в соответствии с прекурсором двуокиси титана: сульфатный и хлоридный. Исторически раньше начали использовать сульфатный метод (1931 г.), затем в промышленность был внедрён более экономически выгодный и менее опасный для окружающей среды хлоридный способ (1948 г.).
Сульфатный способ производства
При данном способе получения диоксида титана исходное сырье подвергают измельчению и смешивают с концентрированной серной кислотой. Полученный раствор охлаждают и очищают его от сульфатных солей. Гидролиз готового раствора осуществляют посредством введения зародышей, после чего добавляется едкий натр. Чтобы добиться высокой степени гидролиза, близкой к 100%, проводят циклы нагрева, разбавления и кипячения. Готовую суспензию диоксида титана, связанного с молекулами воды, очищают от примесей и обрабатывают при высокой температуре в присутствии зародышей рутила или анатаза, в зависимости от того, какая форма соединения требуется на выходе. Недостатком метода является сложность очистки получаемого продукта от примесей металлов и немалое количество отходов.
Хлоридный способ получения
Хлоридный способ синтеза материала TiO2 основан на одной из следующих технологий:
1. Гидролиза водного раствора тетрахлорида титана
2. Парофазного гидролиза TiCl4
3. Термообработки TiCl4 в атмосфере кислорода
Метод был изобретён для производства рутильной формы диоксида титана и заключается в проведении высокотемпературных реакций в газовой фазе. Руда, содержащая титан, взаимодействует с газообразным хлором, и образуется тетрахлорид титана и примесные соединения хлоридов других металлов, которые удаляют. Очищенный тетрахлорид титана затем окисляют при высокой температуре, в результате чего образуется требуемый продукт — диоксид титана.
Золь-гель метод получения наночастиц диоксида титана
В последние годы активно изучаются способы изготовления нанокристаллического диоксида титана для фотокаталитической очистки воды и окружающей среды от токсичных органических соединений и вредоносных организмов. Золь-гель процесс является одним из главных методов получения материалов в виде наночастиц, нанонитей и тонких пленок.
Преимущества метода:
-
Простота
-
Гомогенность
-
Чистота конечного продукта
-
Возможность легко вводить легирующие примеси
-
Синтез пористых структур
Данный процесс представляет собой превращение коллоидной суспензии - золя в вязкий гель, обладающий механическими характеристиками твердого вещества. Для формирования золя обычно применяют соли металлов или алкоксиды: алюминаты, титанаты. При синтезе диоксида титана этим методом в качестве прекурсоров используют тетрахлорид титана. Его гидролизуют и полимеризуют. Полимеризация способствует увеличению концентрации дисперсной фазы золя и построению контактов между частицами. После извлечения растворителя образуется гель, который затем сушат и получают наночастицы диоксида титана со средним размером частиц 22±9 нм.
Гидротермальный метод
Гидротермальный синтез — это проведение реакций в водных растворах при высоких температурах (до 500 °C) и давлениях (10–300 МПа) в автоклавах. Диоксид титана образуется из тех же веществ, что и в золь-гель методе. Изменяя состав раствора, температуру и давление, можно влиять на размеры, структуру кристаллов и состав продукта. Преимущество метода — возможность синтеза крупных кристаллитов диоксида титана, обладающих высоким качеством. Недостатком является высокая стоимость оборудования. Гидротермальный метод может быть модифицирован воздействием на сферу реакции ультразвуком или микроволновым излучением для увеличения скорости синтеза.

Образцы TiO2, синтезированные гидротермальным методом
Диоксид титана, или титановые белила — вещество, используемое в качестве добавки в лакокрасочные материалы, продукты питания, фармакологическое препараты, полимерные изделия. Материал содержится в титансодержащих рудах и производится сульфатным и хлоридным методами, также развиваются более современные золь-гель и гидротермальный методы его получения.

